
NNIT生命科学咨询总监路璐女士
大家好!我今天演讲的题目叫做“IT在药品身份追踪领域的应用”。先简单的进行一下自我介绍,我以前在药厂工作,在IT行业做了9年多的时间,大部分的经验都是和GMP、临床试验相关的领域,做验证和数据文本管理相关的项目比较多。
研发数据的特点:多、乱、杂
那么既然是IT与研发创新分会场,我就在演讲之前,先跟大家分享一下,研发跟我们生产、数据的流通的行业到底有哪些不一样的地方,特点是什么?我总结了三个:第一个,“多”。就是经常会在研发过程中去查各种各样的资料,这个在药品生产的时候是不会出现的,生产追求的是稳定是持续,它基本上已经按照既定好的SOP来做,这个是和研发不一样的地方。第二个,“杂”。首先来源非常杂,比如有生化的、有中药的、有药理提取的等等,而且数据的格式不同,有些是网络的、纸质版的等等,数据非常难管理,尤其在做一些大数据分析的时候,很难被利用。第三个,“乱”。这个是跟其他一些受控的领域来比,比如GMP、临床,它的研发数据的管理相对比较混乱的,这也是为什么我们在某些药厂做GMP数据完整性咨询的时候,通常要求要把生产数据和研发数据分离开来。
ISO IDMP
欧洲药品行业现在流行的话题不是刚才我讲的GMP数据完整性这些,而是一会儿我要介绍的ISO IDMP相关的东西,就是药品身份追踪的确认。
为什么我要跟大家介绍这个东西,并不是我有多了解,只是丹麦的朋友给我一些资料,了解一些皮毛,但是我觉得现在非常严峻的一个事情就是现在欧洲很多企业已经动起来了,已经在做这些事情了,FDA马上就要按照欧盟的这套标准去走,可我们国内做这个领域的人几乎没有听过这样的一个标准。所以针对整体的研发、针对整个药品身份周期的数据要求,我觉得有必要跟大家介绍一下这方面的信息的。今天主要给大家介绍ISO IDMP的标准和数据安全性这两个方面。
什么是ISO IDMP?
刚才说的药品身份追踪的标准叫ISO IDMP,到底什么是IDMP(Identification of Medicinal Products)?它其实是5个ISO的标准,用于标准化药用产品的唯一标识,这5个标准是世界通用的,专门针对药品身份确认的标准。
为什么在欧洲要实行和推行这5个标准?其实它的来源和药物警戒,也就是和很多不良反应是相关的,大家知道,欧美很多法规的出台是和很多血的教训紧密连接在一起的。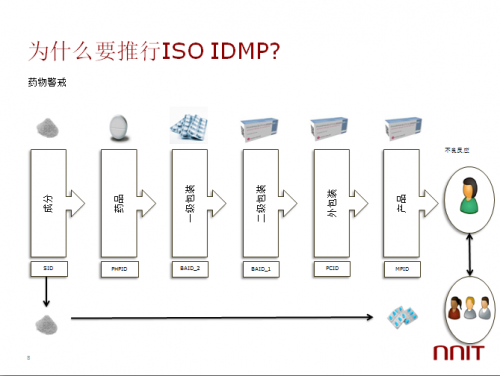
一个药品首先是有成分,成分做成药品以后,有各级的包装,包装后成为商品,最后走到消费者这里。如果一旦消费者有了不良反应和问题的时候,怎么去追溯?我们现在有药监码,但是我们国家药监码不是特别成熟。现在欧盟的药监码,包括FDA出台的一些关于供应链安全的法案,其实所有的驱动力都是在药物警戒,目的就是一旦有人吃了这个药以后,怎样快速避免风险的扩大,快速进行追溯和召回。
目前欧美可以做到的就是可以很迅速的知道除了这个人买了这个批号的药以外,还有哪些人买了这一批号的药,这个是可以追溯到每一个消费者的。但是他们还是不满足,希望可以追溯到成分。这个是目前我们做不到的,在全世界范围内也做不到。
举个简单的例子,有很多的感冒药,扑热息疼是里面的成分之一,其实它是很稳定的。假如,有一天扑热息疼对怀孕的妇女是有问题的,那怎样知道还有哪些药物有这些成分?这就是欧盟正在做的事情,他们在2016-2017年已经开始在推行这个标准,希望在2020年之前,所有在欧盟报批的药物都要标准化。因为只有数据标准化,才能做到从产品直接追溯到成分。所以对于药品行业来说,我觉得这个是非常伟大的事情。这个其实是一个联合的,最早是ICH发起的,后来通过ISO的组织,把很多标准做了定义和深化,现在已经是全世界在通用的标准了。
IDMP能给我们带来什么?
其实在丹麦,在欧洲我们做了一些资料的调查,找了很多药厂的CIO和他们去聊这个标准。其中有84%的人认为这是机遇和挑战并存的事情,有8%的人比较单纯的认为这就是一个机会,更外8%的人觉得这就是一个威胁,对药厂来说是一个灾难,要投入很多的成本来做这个事情。所以大家想法还是不太一样,普遍讲,大家觉得机会在哪里?第一,加快研发。因为数据有标准了,以后查数据文献、调用数据更加方便。第二,数据标准化。第三,过程全球化。第四,增加透明度。第五,不同的药监机构之间可以更好地互相认可,比如以后的eCTD去报批的话,因为都是标准的,那么在欧洲报批之后在美国就可以了,还有像很多海外过来的药,在国外已经认可了,但是在国内还要再做注册报批,这其实也是很大一部分的成本。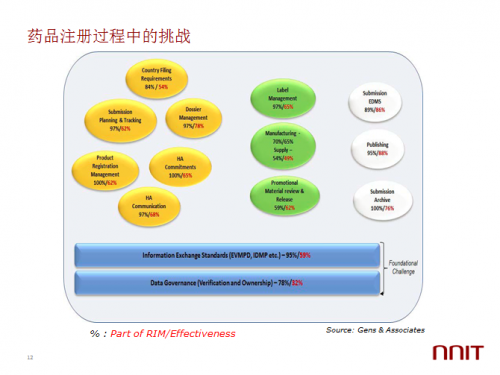
目前在药品注册过程中有很多的挑战,比如标签的管理,可能标签上的信息有97%都要放在注册申报的资料里,65%是在注册的时候能够从标签上来拿过来用的有效性。所以像标签、还有产品本身注册的信息、产品的计划等,它们占到注册的百分比很大,但是数据能直接引用的几率很小。所以还是希望药品的数据能够更好地做标准化。
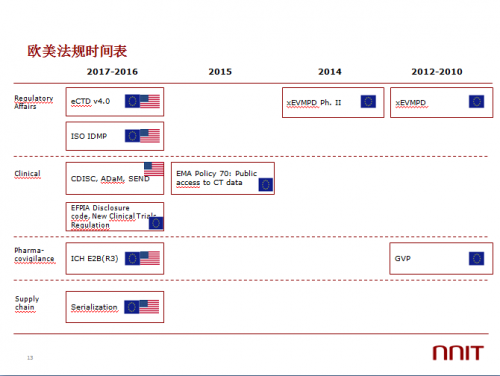
大家可以从欧美法规的时间表来看,其实基本上都是和药物警戒相关的,很多像数据完整性这些东西都不在他们的范围里。比如eCTD、ISO IDMP、还有跟临床试验相关的,是要把临床试验的数据标准化,比如如果说性别就都用sex,如果在报批资料里用了gender,那么这个报批资料就会被退回,不会被受理。还有像Serialization也是和药品追溯相关的。大家都知道,未来的趋势发展,更多的是要放在和生命相关的领域,能够快速的去追溯去召回,但它的前提一定是数据的标准化,不管是注册数据、报批数据、临床试验数据还是生产数据,都要把它做成标准化的,才有可能达到这个效果。

6
现在系统的现状是:不同的数据在不同的系统里,比如生产的数据在ERP里、不良反应在Safety里,注册的数据在RIMS里等等。那么未来的趋势:就是在不同系统中间有一个Hub,能够转换的工具,把很多东西做智能化的集成,同时可以进行数据清理,把不标准的数据做成标准的。目前很多系统在欧洲已经上的很多了,很难说比如把Safety系统库不要了,重新做个新的换一个标准的,更多的是去加一个Hub,把所有数据里面不标准的数据做成标准的,然后可以做报批。这样就可以说大数据就真的有意义了,因为这个数据是真的可以拿来作分析了。
怎样去做IDMP?
在国内目前基本上都没有,甚至都不知道有这样的一个标准,所以我现在所有这些信息和资料都是从丹麦的顾问那里拿到的,是他们现在在欧盟已经在做的项目,比如他们提到的:跟主数据的管理有关、跟数据的质量有关、跟数据整体的治理有关。还提到了比如:每个系统定义数据所有者,就是这个数据到底归谁所有,那么他就对这个数据有责任的。
在很多产品生命周期的过程中也要做一些追溯。大家可能会问到,真的要做IDMP常见的问题是什么?ISO IDMP的数据在哪里?有多少ISO IDMP 数据是可以获得的?数据在IT系统里还是在文档里?谁应该是数据的所有者?我们现在的数据如果报给欧盟是否能满足要求?还有一个最重要的就是到底要花多少钱?这个是最实际的问题。
那给大家看一些简单的案例,到底会有多少数据受影响?比如报批,在现在的标准里,对不良反应上报,要有4个类别的描述一定要写:不良反应具体的信息是什么、症状、在什么情况下出现、频率等。在欧洲,统计一个药品通常会有30个不良反应,按照一个不良反应有4条要上报,这样算下来这样一个条目大概就要报120条左右。还有药品名称的不同也会带来混淆,比如粉针,在英文名字里有人叫Solvent,有的人叫Vial,在消费者眼里可能叫Solution for injection也可能叫Syringe等等,所以这些名字的不统一带来的混淆就会给注册报批带来困扰。一旦这些不能统一的,那么一个药里发现有成分有问题,再去追溯到底哪些药里有这个成分,根本是不可能的事情。
所以现在在他们的标准里基本上就是把数据做成标准化, 5个ISO的标准,每一个标准都非常厚,所有的条目都做了标准化,比如包装盖子就叫Cap、铝的话以前会写AL,但是以后都要用全名aluminum、包括长宽高、还有颜色等等所有的东西都做成标准化,以后就可以搜索和管理了。举个例子,像刚才提到的Paracetamol,中文名就有很多比如扑热息痛、退热净等等,英文还有很多别名,如果不做统一标准的话,那在审批和召回的时候就有遇到非常多的问题。这个会给我们以后用药安全带来非常多的好处。
还有一个例子就是,国外的两个药品,除了成分是一样的、规格也是一样的都是500毫克,而且都是片剂,所以说剂型也是一样的,那么我们就把它认为是一种药品,只不过是不同的商品。但是还有两种药品,它们的成分是一样的,可规格、剂型都不同,那总的来说它们就不是同一种药品。所以说这个标准是在做排列组合的工作,赋码编码后,一样的码就是一种药,如果码不同就不是同一种药。
这些数据在公司的什么地方?
大家都知道,我们在注册的时候一般都会到很多地方去找这样的数据,有些大的药厂会上RIMS、ERP大家基本上都有,像标签的系统、化学成分库,这些都是在研发地方都有,还有像文档系统里都有这些东西。
来自于全球IDMP项目的经验:我了解了一些在欧洲做这些项目的方法论,对这个标准非常懂得的那些顾问,要到厂里做很多调查,平均在欧盟自动化程度比较高的厂里,他们要做40-60次,有一些国际化的药厂,所以他会涉及到多个国际和地区,可能平均涉及到12个系统,这个我估计在国内没有这么多,有些看国内的药厂,全厂也没有12个系统,但是对于他们起步比较早,所以很多系统都有,包括60%-70%强制性的IDMP的要求,其实都是电子数据,都在IT的系统里。那么他们的设计大多不符合,因为标准是后出的,所以现在还是要做一些改变,比如刚才提到的Hug,把其他数据库里的数据都拽进来,做一个规范,可以保证这个数据是可以被欧盟的药监部门所接受的。
来自行业的反馈
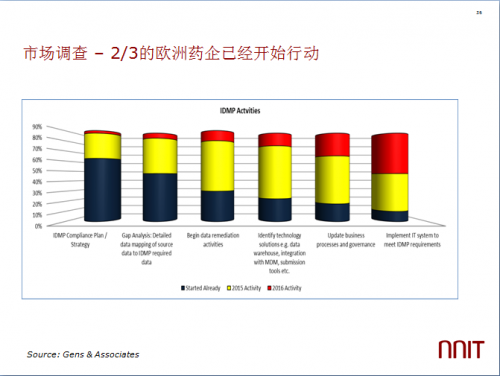
在欧洲企业做的一些反馈,2/3的药企都已经开始行动了,比如IDMP标准合规的计划、战略、分析、用什么样的数据仓库、怎么样做集成等等,基本上都是在2016年要完成的。有60%的欧洲的药企认为,如果等到欧盟正式颁布这个标准的时候在做打算,那么是要面临非常大的挑战的,因为这会涉及到很多IT系统的改变,所以不能等要马上开始行动。
如何保证研发数据的安全?
关于如何保证研发数据的信息安全,简单的和大家说一下。这个跟大家是息息相关的,我们的研发数据都有哪些渠道是会泄密的,比如U盘口、勒索病毒,所以研发数据除了开始说到的多、乱、杂以外,还有一个它的机密性要求是很高的,有很多方面的威胁,所以我们要做各种各样的控制,比如上网行为管理、IT运维监控、软件安装控制还有包括终端安全的控制,比如终端数据防泄密、文件共享、物理安全等方面。我今天就先介绍这么多,谢谢大家!






