本文由CIAPH根据云顶新耀信息负责人曹辉在“研发实验室管理”专题线上会中的演讲整理
众知,大多数药品的诞生会经历四个阶段:发现阶段、临床前开发、临床开发、注册批准,不同的阶段将会涉及到多个研发平台。本次讲解中,云顶新耀信息负责人曹辉强调,在药品的整个生命周期中,药企只有不断提升研发效率,才能获取最佳的产出。未来在数字化赋能医药研发领域,存在很多机会点,全数字化的智能实验室、人工智能(AI)、RWD、DCT、RPA、云等技术应用,将为药企研发的降本增效提供更多可能。 各位行业同仁大家好,我是云顶新耀的信息负责人曹辉,非常荣幸能够通过CIAPH(医药健康信息化联盟)搭建的线上平台,与大家分享探讨集采时代数字化赋能医药研发创新的话题。

曹辉 云顶新耀信息负责人
从医药行业的大背景来看,目前整个行业的内卷非常严重。集采政策已经成为一种常态化趋势,在兵家必争之地肿瘤领域,CDE发布了关于肿瘤的临床指导规范,强调以临床需求为导向、以患者利益为基础,避免低质量的重复临床实验。整体来说,药企的发展面临着严峻的挑战,相比较而言,拥有真材实料的创新药企和物美价廉的仿制药企更具发展优势。
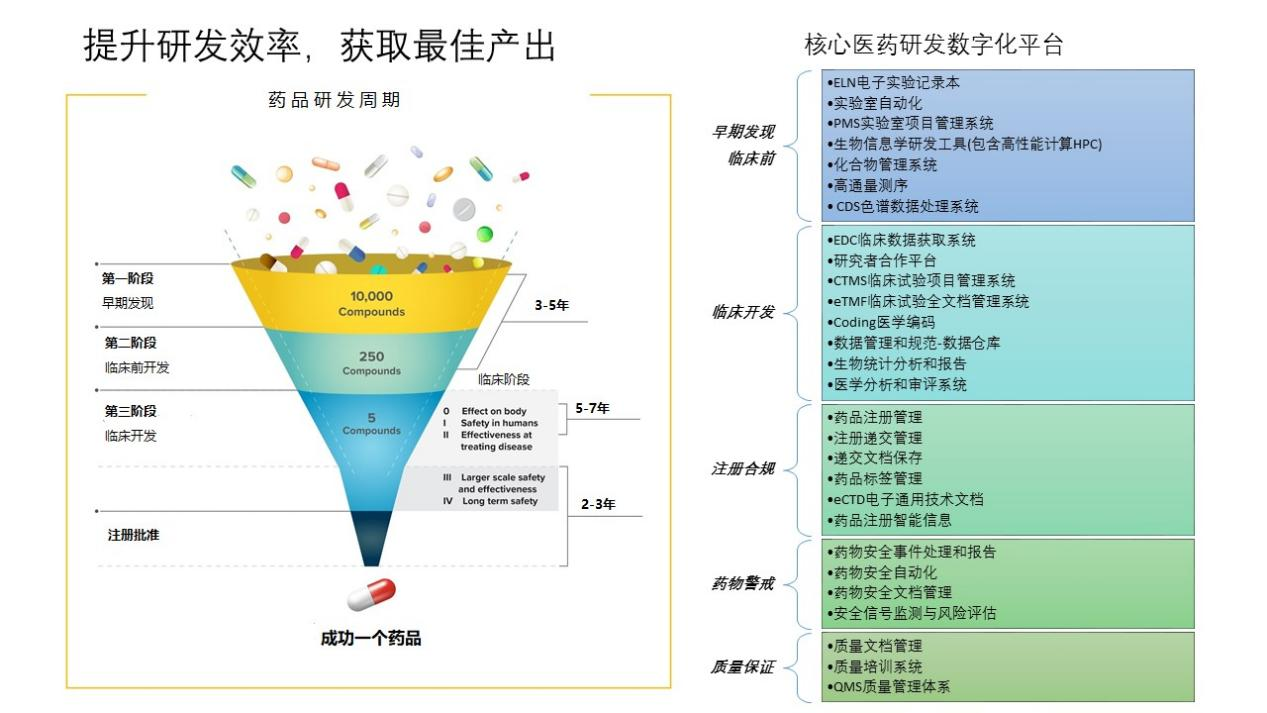
以往在业界流传着一条“双十”定律,讲的是一款药物的研发,需要十年时间和十亿美金,如今看来,这是远远不够的,需要更长的时间和更多的资金,而且成功率也下降到2%左右。下图中左侧展示的是药物研发的周期,从药品研发的整个周期来看,大致可以分为3个阶段:
早期发现:从Compounds中进行药物靶点的发现;
临床前开发:证明哪些药物是有效并且安全的;
临床开发:进行人体实验,同时包括后期的审批等。
从药品研发的整个周期来看,与IT是息息相关的:早期的发现需要信息化手段来进行信息收集,实验室设备的互联,病人数据的收集分析,通过数字化平台生成统计数据图表,得出药品是否有效的结论等等。下图中右侧展示的内容为一个研发型药企(规模为中型药企)需要配备的医药研发信息化平台,对于一些大型药企来说,研发平台会更多且更为复杂,这是因为药品的研发需要满足严谨的SOP流程,同时要满足高合规的要求。对于IT人员来说,需要与科学家打交道,因此对于业务的理解至关重要。
相对来说,国内的很多创新药企的研发平台并没有做到像图中展示的这样全面,更多的企业仍然采用外包的方式,通过采用与CRO合作的方式,逐步进行研发数字化的建设,当然随着企业中系统平台的不断完善,逐步将CRO中的数据转移到企业自建平台中,也将进一步保证数字化研发效率的提升。
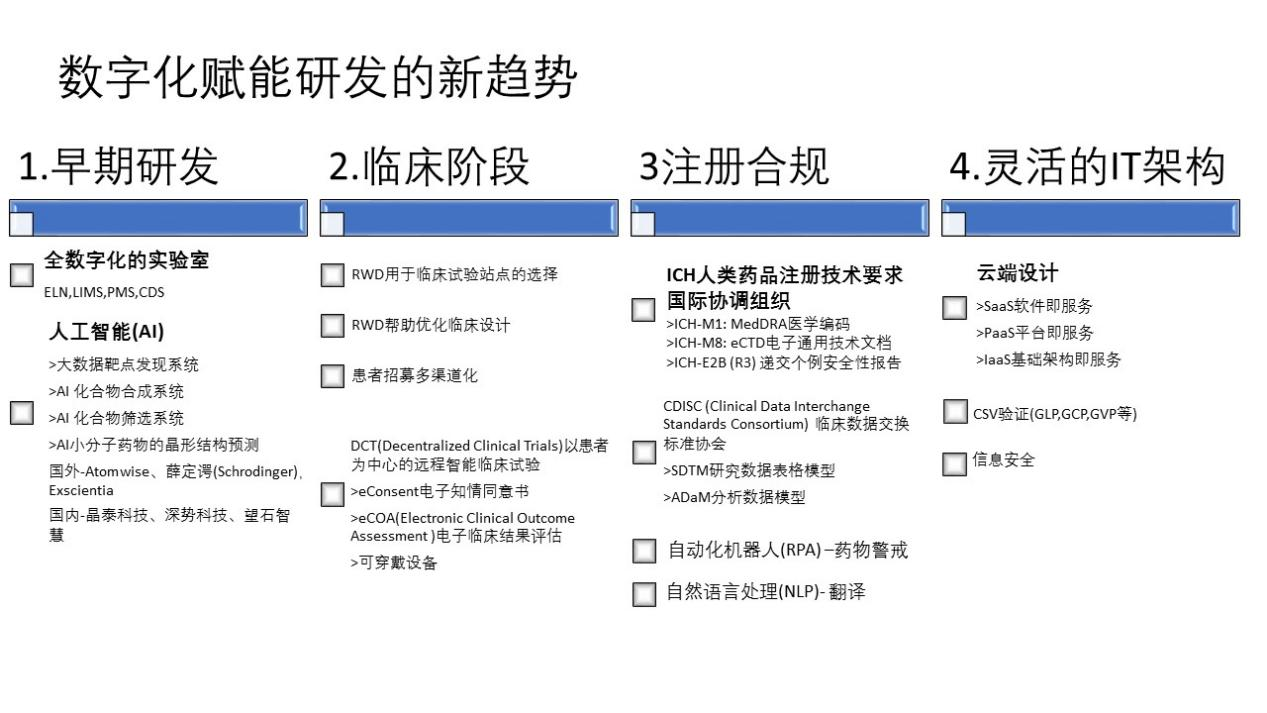
随着科技的发展与进步,在医药研发领域,诸多新技术被广泛应用,我将数字化新技术对于医药研发的赋能分为四大领域。
早期研发领域
早期研发是最容易发力的阶段,全数字化实验室目前被大家广为接受和应用。此外,像人工智能(AI)的应用,为药物的研发提供有效的助力。随着大数据和计算机技术的迅猛发展,计算效率和算法以及数据的可靠性得到了充分的提升,借助AI的能力,能够更快地发现靶点,同时依托大数据和人工智能的学习和搜寻能力,能够快速进行化合物的虚拟合成与筛选,同时也能进行小分子药物的预测。目前在这一领域,国内外有很多优秀的企业在不断探索中,也取得了丰硕的成果。
临床领域
在临床阶段,首先可以通过RWD(真实世界数据)进行临床实验的站点选择,通过这些数据,判断人口分布、生活习惯、饮食习惯、处方信息,从而使临床的实验站点能够更好入组。此外RWD也能够优化临床设计,部分药企临床入组设计的条件较为苛刻,通过RWD能够适度放宽入组条件,而且不影响初始的实验设计。另外一个机会就是患者招募的多渠道化,例如患者通过网站、微信、小程序、支付宝来找到项目的信息,方便报名和入组。
随着技术的不断发展,DCT实现了以患者为中心的远程智能临床试验,它区别于现阶段以医院为中心的治疗方式,能够通过电子知情同意书、电子临床结果评估、可穿戴设备的方式来对患者进行临床试验,做到了以患者为中心。DCT的使用适应最近新冠疫情的需要,但是现阶段很多企业由于限制还不能全部采用DCT,更多采用混合的方式,以医院为中心或者以患者为中心。
注册合规
注册合规阶段,不得不提ICH(人用药品注册技术要求国际协调会议),该组织最早为美、欧、日牵头成立,制定了药品注册的相关规范,中国于2017年加入,在加入该组织之前,我国依照的是WHO的相关标准,而ICH作为发达国家的最低标准,我国快速跟进,并且成为了管委会成员之一。以患者为首位是ICH的一个重要的特点,此外ICH应用了很多信息技术,首先M1:MedDRA医学编码统一了临床和药品安全领域的编码,实现了标准化;M8:eCTD电子通用技术文档能够标准化注册文档的树状结构,实现通过DVD光盘的或Gateway的方式将数据传输至药监局;E2B(R3)于药物警戒和安全领域非常重要,很多药企在实施药物安全管理系统的时候都将以E2B(R3)的标准进行递交。
关于CDISC(临床数据交换标准协会),它规定了临床数据怎样收集、交换、递交,近些年从一个民间组织上升为全球标准,其中SDTM研究数据表格模型和AdaM分析数据模型非常重要,进行临床数据标准化和分析的时候,能够快速分析药物是否有效。此外RPA和NLP的应用也在一定程度上促进了药企在注册合规领域效率的提升。
灵活的IT架构
想要打造灵活的IT架构,云端的建设非常重要,尤其对于一些规模较小和初创企业来说,很多系统还未开始建设,因此提前对云端的建设进行规划非常关键,其中可以选择SaaS软件即服务、PssS平台即服务、IaaS基础架构即服务的方式,具体选择何种方式,需要从企业研发系统的特性和不同的需求出发,而且采用云端的设计后,企业自身的机房设计可以更加轻量化地建设相关的系统。
医药研发还会涉及到CSV验证,要满足GLP、GCP、GVP相关的要求,所以企业在打造研发系统时,一定注意不仅要保证软件系统层面符合要求,而且底层的服务器、后端的支持系统也要进行CSV的验证。
最后需要注意的就是信息安全,云端的系统在敏捷性上有一定的优势,但是可能受到的威胁和攻击也比较多,因此在进行云端系统建设时,既要满足国家相关的要求,同时也要考虑到数据存储的安全。
以上内容就是我想为大家分享的全部内容,在此也希望数字化进程的加快能够为药企带来更多能量,赋能药企研发快速高质量发展。谢谢大家!






