本文由CIO发展中心根据西比曼生物数字化转型负责人曾熠在“生物医药云上安全合规之核心” 专题线上会的分享整理
随着信息技术的发展,新一代数字技术带来了深刻的影响。但是在企业数字化的过程中,质量管理是不容忽视的一环,尤其是对于生物药企来说,涉及到国计民生,质量管理的数字化成为药企发展的必由之路,同时也是提升企业发展效率的重要支撑。在“生物医药云上安全合规之核心” 专题会上,西比曼生物数字化转型负责人曾熠针对质量管理数字化,介绍了他的实践与成果。

曾熠 西比曼生物数字化转型负责人
大家好,我是曾熠,很荣幸今天有这样一个机会与大家进行线上交流。
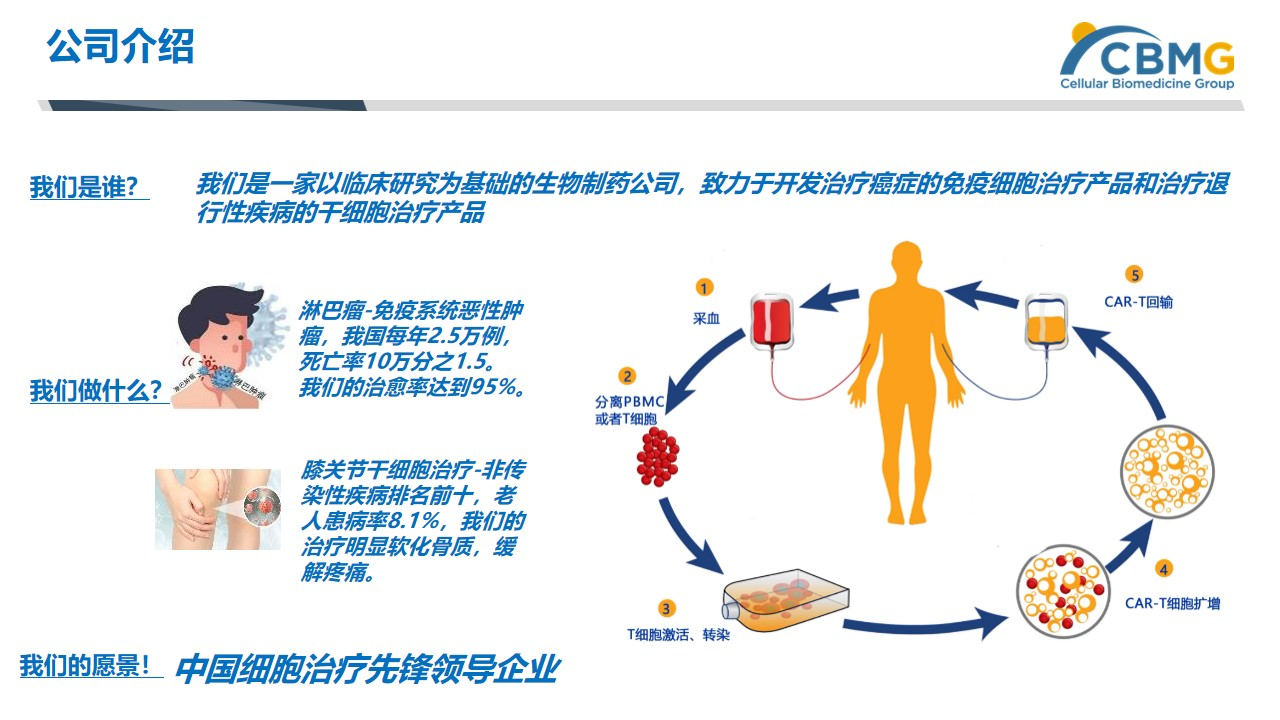
西比曼生物科技有限公司(简称西比曼生物)是一家以临床研究为基础,致力于开发治疗癌症的免疫细胞治疗产品和治疗退行性疾病的干细胞治疗产品的生物制药公司。目前公司主要采用以CAR-T为主流技术进行相关的细胞免疫治疗技术,从疗法上简单来说,就是将人体内的免疫细胞抽取出来,通过培养放大,再回输到体内,通过培养的免疫细胞能够自动识别肿瘤并进行攻击而达到治疗的目的,这样的治疗方式相对安全、高效且对人体影响最小。但这种治疗方式最大的问题有2个,一是,它属于个性化治疗的范畴,价格比较昂贵;二是,治疗方法范围覆盖相对有限,目前也仅限于针对淋巴瘤和血液瘤的相关治疗,未来可能会延伸到实体瘤的治疗领域。
作为生物医药企业,大家或许都深有感触,从临床开始,到生产、质量、病患治愈的过程中,产生的数据越来越多且非常难以进行深度分析和利用,而且具有海量、多样、速度的三大特性。当产生的数据越来越多的时候,大部分企业会选择将数据存储起来,以满足审计和追溯的要求,但是有很多数据却难以确定是否能提供相应的价值。在过去,传统的药企面临的挑战是,设备能否存储大量的数据仅仅考虑空间的容纳问题,而现在要求对企业产生数据不但要留存甲方或者监管方规定的时间,且从公司运营的角度来说,未来对于这些数据如何使用,有哪些规划则提出了更高的要求。因此,药企在这些数据的管理成本投入越来越大,管理越来越复杂,所以如何将数据转化为数据资产,企业现在也面临着重重的挑战。
从企业IT和合规的角度来说,对于生物医药企业的合规以及数据完整性的要求重点在于四个方面,首先就是操作简单,其次是数据可用,另外就是安全可靠,最后是符合管理规范。如果能够做到以上四个方面,不论是将来甲方还是监管方做现场审计的时候,都应该能够比较顺畅地应对。
我所在的细胞治疗行业属于个性化治疗的领域,与传统的生物药和小分子化药有所不同,因为传统的生物药品或者小分子化药的生产流程已经很完善,且能够大规模生产,同时所有的过程非常标准化,所以整个流程相对流畅和容易控制,数据流向来源和分析也比较清晰;而个性化治疗领域在这些环节里面则有很多的不确定性和非统一要求,但是规模化和标准化一定也是细胞治疗药品生产的最终要求。于是从2020年开始,国家监管机构开始对于细胞治疗领域提出了很多要求,所以我们在药监的指导下,针对数字质量要求,推广了E-Tracking平台。
E-Tracking平台是多种理念的融合,在众多的生物药企中,为了达到管理和协同的目的,企业都开始逐步部署各种专业或者非专业的系统。例如我们熟悉的LIMS、QMS、DMS系统等,这些系统往往在部署和使用之前都表示能够与其他的系统兼容,但是真正使用起来以后就会发现,在错综复杂的情况下,很容易出现各种问题。因此我希望能够研发一个平台,将所有的这些系统进行整合,通过功能的整合,能够对细胞追溯和流程进行快捷的精细化管理。不过在实际操作的过程中就会发现,上系统容易,真正困难的是推系统和系统落地,因此在近三年的实践中,我们才通过对E-Tracking平台的整合,产生了一定的成果。
首先,一个细胞治疗追溯的平台,起码要覆盖的是患者入组、评估、采血、回输、观察几个步骤,这些看似简单的过程,想要进行协同却非常困难。所以对于整个生命周期,我们进行了最重要的改进,简单的说就是以简化繁:通过前端二维码+后端平台系统的方式进行追溯,在建档的过程中,使患者信息进入到了移动端,原因在于很多用户对于系统是排斥的,所以通过最容易的方式与其进行接触,效率就会大大提高。另外通过手持式的终端设备进行扫描,能够将所有的信息整合,并且将整个过程形成一个闭环。另外一个好处就是通过手持设备,所有产生的数据和信息都存储在后台,并且能够根据不同的甲方和监管要求来进行提取,充分提升数据的价值。

在安全上,我们将复杂的技术与算法掌握在自己的手中,很多底层的算法与系统的对接是在后台实现的,因此甲方和监管方时能够看到的内容更多是一个流程、状态中的信息,对于一些技术性的内容,是相对安全的。
整个患者生命周期的闭环,在线下通过手持终端,在线上通过追溯系统进行管理。过去我们在做患者入组的时候,通过邮件、微信等方式进行反复确认,耗时非常长,有些外地的患者甚至要达到4天。通过使用这样的系统,我们将患者唯一追溯标签的耗时由96小时缩短为1分钟,不仅节省了时间还大大压缩了系统的成本。因此带来的成效也体现如下:2017年,第一款CAR-T在中国落地时约47万美金,约300万人民币,经过几年的改良,逐步递减为120万人民币,我们认为这一成本还有下降的空间,通过数字化未来3-5年,能够降到30-50万人民币。通过对整个流程进行梳理,我们将治疗的流程由原来的15天缩短至6天,为病患争取到了更多的治疗时间。

通过实施这样的项目,作为IT来说,技术不是难题,但是如何将技术落地是一个难题。所谓的生物医药安全合规,首先自身要对质量有所保证同时要理解业务方的需求和痛点。此外,我们所有新药上市最后的关卡在监管,所以要明确监管对于合规的要求。很多时候,质量体系的人提出要求仅仅是根据监管发布的规则中凭借字面表达进行理解的,因此会在落地时容易产生偏差。
如果我们IT在上系统的时候在项目早期与一线监管进行沟通和交流,得到其认可后,再回过头反推业务和质量体系,就能够减少后期监管审核的阻力,而且在内部推广时,质量体系与业务系统的理解能力与接受度都能进一步提高。因此,CIO在落地时就能更好地开展工作,达到双赢的目的。
以上内容就是我今天为大家分享的一个案例,现在该系统已经上线,并且产生了一些实际的经验,如果各位感兴趣,欢迎进一步详细沟通,谢谢大家!






